28 de mayo de 2021
Biofilms en la industria alimentaria
¿Qué son los biofilms?
Los biofilms son estructuras complejas formadas por microorganismos que se fijan firmemente a una superficie mediante una matriz extracelular (conocida como EPS “extracelular polymeric substance”), generada por secreciones de los propios microorganismos y compuesta principalmente por polisacáridos, proteínas, lípidos y ADNe (ADN extracelular).
La creación de la matriz EPS supone para los microorganismos un coste energético muy elevado, que se ve ampliamente justificado por las ventajas evolutivas que le confiere el sistema, otorgándole, entre otras, las siguientes propiedades [1]:
- Resistencia a la desecación.
- Resistencia a ciertos antibióticos.
- Resistencia a desinfectantes, tanto basados en tensioactividad como en poder oxidante.
- Resistencia a la luz UV.
- Disponibilidad de nutrientes.
- Intercambio horizontal de material genético.
Esta estructura permite una rápida proliferación de los microorganismos, al proporcionarles un medio de protección con las condiciones óptimas de humedad y disponibilidad de nutrientes.
La mayor parte de la biomasa del biofilm corresponde a la matriz extracelular cuyo componente principal es agua (hasta un 97 %). La formación y mantenimiento de la comunidad celular depende de la producción de la EPS[2]. Los componentes que forman la EPS presentan diferentes funcionalidades:
- Los polisacáridos solubles le confieren una consistencia gelatinosa y tienen un papel principal en la retención y disponibilidad de agua.
- Los polisacáridos insolubles, de mayor tamaño, aportan rigidez estructural.
- Las proteínas y enzimas intervienen en la digestión de macromoléculas y disponibilidad de nutrientes.
Aunque existe la posibilidad de encontrar biofilms formados por una única especie, los tipos de biofilm más frecuentes son aquellos formados por más de una especie bacteriana e incluso otros tipos de microorganismos que proliferan habitualmente en las superficies.
La morfología del biofilm es muy variable y depende principalmente del tipo de superficie donde proliferen, el tipo de microorganismos que lo componga, su viabilidad y el tiempo de vida y espesor que haya alcanzado.
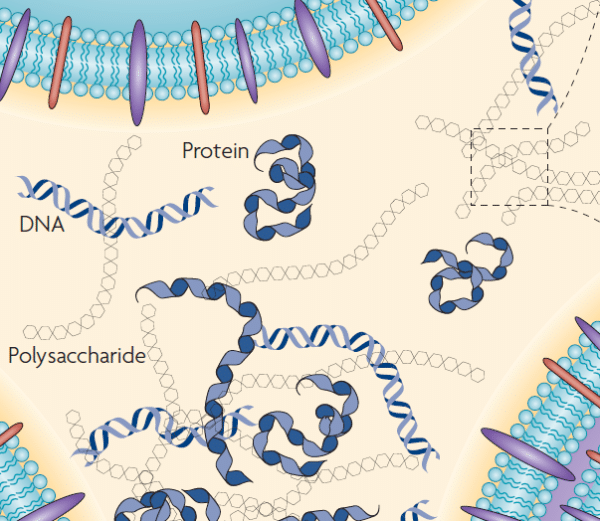
| ©Flemming & Wingender |
Principales componentes de la EPS [1]
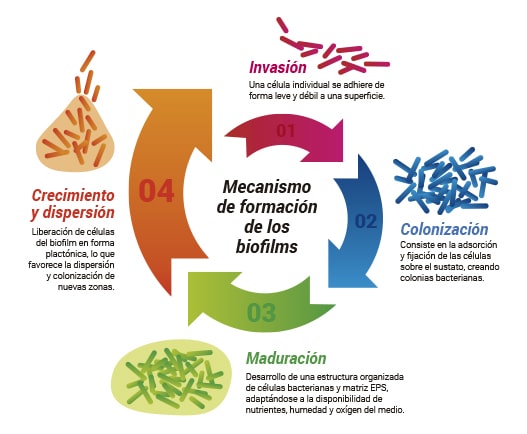
Mecanismo de formación de los biofilms
La formación de los biofilms es un proceso ampliamente conocido, aunque sigue siendo objeto de estudio para profundizar todavía más en los mecanismos concretos que lo componen. El proceso se inicia cuando células plantónicas empiezan a adherirse en una superficie (metálica, plástica, …) y secretan sustancias viscosas (EPS) que fortalecen la adhesión y cohesión, a la vez que favorecen el crecimiento y la incorporación de nuevos microorganismos al sistema.
El mecanismo de formación de los biofilm, de forma general, se puede dividir en las siguientes cuatro etapas:
- Invasión – En esta fase, las células plantónicas empiezan a adherirse de forma débil a la superficie. La deposición por gravedad y el anclaje favorecido por la morfología de la superficie y la presencia de residuos, son los mecanismos más habituales de adhesión.
- Colonización – Fuerzas de atracción electrostáticas y estructuras celulares como flagelos, fimbiras y pili son los tipos más habituales de adhesión en los primeros estadios de esta fase. Esta primera adsorción es relativamente fácil de revertir, las fuerzas de Van der Waals y la atracción electroestática pueden verse superadas por la repulsión natural causada por la carga negativa de la membrana celular en contacto con la superficie (habitualmente con carga negativa), algunas de las células colonizadoras pueden volver a separarse del sustrato.
A partir de cierto tiempo, dependiendo de variables como temperatura, disponibilidad de oxígeno y nutrientes y humedad, se fortalece la adhesión celular; los apéndices extracelulares reafirman su anclaje al sustrato y la formación de la matriz extracelular creará una adhesión irreversible al sustrato.
- Maduración – Tras un tiempo inicial de latencia, los microorganismos empezarán a dividirse, creciendo hacia la parte superior del biofilm en estructuras típicamente en forma de seta. Los biofilms pueden alcanzar elevados niveles de complejidad, creando sistemas eficaces de distribución de nutrientes y llegando a niveles de estratificación que permiten el crecimiento de especies anaeróbicas en ambientes con presencia de oxígeno gracias a la protección de una capa aeróbica. Distintas especies formadoras del biofilm pueden colaborar entre sí, intercambiando material genético, sintetizando enzimas y proteínas específicas y creando gradientes que favorezcan su crecimiento.
- Crecimiento y dispersión – En esta fase se liberan al medio células que vuelven a su forma plantónica y que pueden originar, en caso de cumplirse las condiciones necesarias, nuevos focos de formación de biofilm. La duración de esta fase, y del biofilm en general, estará determinada por la disponibilidad de nutrientes y el cumplimiento de las condiciones necesarias para su supervivencia.
Factores que favorecen el desarrollo de biofilms
Los principales factores que intervienen en el desarrollo de un biofilm pueden clasificarse en:
- Microorganismos – El tipo y diversidad de especies que formen el biofilm, así como las concentraciones iniciales y su viabilidad, pueden marcar las posibilidades de éxito en su formación y su permanencia en la superficie.
- Características del sustrato - Cualquier tipo de superficie que reúna las condiciones de humedad y disponibilidad de nutrientes necesarias, es susceptible de ser un punto de formación de biofilm. Sin embargo, características inherentes a su composición y su estado general de mantenimiento (rayaduras, desgaste,…) pueden influir sensiblemente en la facilidad con la que pueden adherirse los microorganismos presentes en el medio y por tanto, aumentar la posibilidad de formación de biofilm. Por ejemplo, superficies plásticas como teflones, cintas de transporte, mesas de corte o juntas poliméricas, suponen un riesgo mayor que superficies metálicas como mesas, tolvas, cuchillas o circuitos.
No obstante, debemos tener en cuenta que una superficie a priori más segura por su composición, como el interior de una conducción de acero inoxidable, puede suponer un riesgo elevado si se encuentra en mal estado o se ha producido un depósito de suciedad que pueda actuar como punto de anclaje para bacterias presentes en el medio.
- Condiciones medioambientales – Los microorganismos deberán disponer, al menos en las fases iniciales de la formación del biofilm, de las condiciones de temperatura, humedad y disponibilidad de nutrientes necesarias para su crecimiento. Estas condiciones pueden variar ligeramente en función de las especies formadoras, pero de forma general coinciden con las condiciones de humedad y disponibilidad de nutrientes que encontramos en la mayoría de procesos de la industria alimentaria.
Consecuencias de la formación de biofilms
Las consecuencias de la formación del biofilm varían según el sistema o proceso afectado, pudiendo originar importantes problemas de seguridad alimentaria y generar elevados costes tecnológicos.
En la industria alimentaria, los biofilms son causantes de alteraciones organolépticas y contaminaciones microbiológicas de los productos elaborados, actuando como reservorio perfecto para microorganismos patógenos como Listeria, Salmonella y Escherichia Coli entre otros. Interiores de circuitos, conducciones de agua, boquillas dosificadoras, mesas y teflones son sólo algunos de los ejemplos de superficies de industrias alimentarias donde podemos encontrar biofilm.
Los biofilms pueden formarse rápidamente en ambientes industriales, siendo también causantes de otros problemas diversos como corrosión de equipos e instalaciones, obstrucción de conducciones o disminución del rendimiento de instalaciones, como intercambiadores de calor o sistemas de filtración.
La matriz extracelular que forma el biofilm actúa como protector de las bacterias y barrera de difusión física y química, lo que dificulta la penetración de agentes antimicrobianos, imposibilitando una correcta actuación de los protocolos de limpieza y desinfección. Adicionalmente, también aumentan los mecanismos de resistencia de los microorganismos, que se adaptan al nuevo entorno que genera el biofilm.
Unas deficientes condiciones higiénicas en las superficies alimentarias aumentan significativamente las posibilidades de desarrollo de biofilms, debido a las características de la biocapa formada:
- Rápida velocidad de formación de los biofilms (apenas unas horas en condiciones favorables).
- Capacidad de propagación y recolonización.
- Resistencia a procesos de limpieza y desinfección (los biofilms pueden resultar entre 10 y 100 veces más resistentes que las bacterias en suspensión).
- Crecimiento en zonas de difícil acceso (puntos críticos).
- Dificultad que presenta su muestreo, detección (tamaño microscópico) y control.
Por consiguiente, la presencia de biofilms en instalaciones y superficies alimentarias incrementa los riesgos de contaminación microbiológica, pudiendo ser el origen de alteraciones y deficiencias de calidad de los productos elaborados o incluso de posibles brotes de enfermedades transmitidas por alimentos.
Conclusiones
La presencia de biofilms en la industria alimentaria es origen de importantes problemas de seguridad alimentaria, con elevados costes tecnológicos asociados.
Unas deficientes condiciones higiénicas en las superficies alimentarias aumentan significativamente las posibilidades de desarrollo de biofilms, incrementando el riesgo de contaminación microbiológica de los alimentos procesados.
La matriz extracelular que forma el biofilm actúa como protector de las bacterias, dificultando la penetración de agentes antimicrobianos y dificultando una correcta actuación de los protocolos de limpieza y desinfección.
La prevención y eliminación de los biofilms en la industria alimentaria debe tratarse con un amplio enfoque multidisciplinar, que incluya la ingeniería para el diseño de instalaciones, la química para los protocolos de limpieza/desinfección y la microbiología para la monitorización del proceso. Con este enfoque, se podrá evitar su presencia y garantizar la máxima inocuidad de los alimentos procesados.
Referencias bibliográficas:
[1] The biofilm matrix. Hans-Curt Flemming & Jost Wingender. 2010. [Fecha de consulta: 11 may 2020].
[2] The biofilm matrix. An immobilized but dynamic microbial environment. Sutherland IW. 2001 [Fecha de consulta: 14 may 2020].
AUTOR: Dani Calvente
¿Quieres más información?
Te ayudamos
De acuerdo con el Reglamento 2016/679 (RGPD) le facilitamos la información básica de protección de datos personales:
- Responsable del tratamiento: PROQUIMIA, S.A.
- Finalidad del tratamiento: Gestionar el envío de información, solución de consultas i/o recogida de datos para posibles relaciones comerciales.
- Legitimación: Consentimiento del interesado.
- Destinatarios: No se cederan datos a terceros, excepto obligación legal.
- Derechos: Acceso, rectificación, supresión, oposición, limitación, portabilidad y presentación de reclamaciones.
- Información adicional: Puede consultar la información adicional y detallada sobre Protección de datos en nuestra página web: Política de privacidad


